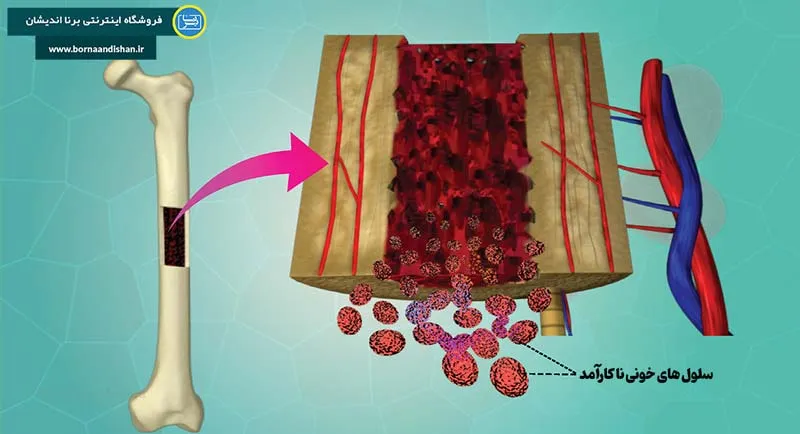
سندرم میلودیسپلاستیک (Myelodysplastic Syndromes) یا به اختصار MDS، گروهی از بیماریهای خونی یا هماتولوژیک هستند که به واسطه کاهش سلولهای خونی (سیتوپنی) و نارسایی مغز استخوان شناخته میشوند. این بیماریها با خطر بالای ایجاد لوسمی میلوئید حاد (AML) همراه هستند. در این مقاله، به بررسی عمیق این بیماری، علل، طبقهبندی، و درمانهای موجود میپردازیم. همچنین، سوالاتی مانند آیا این بیماری کشنده است؟ طول عمر بیماران چقدر است؟ و چه درمانهایی برای آن وجود دارد؟ را پاسخ میدهیم.
آیا آمادهاید تا با یکی از جذابترین و پیچیدهترین موضوعات پزشکی آشنا شوید؟ در این قسمت از مجله علمی برنا اندیشان، قصد داریم شما را به سفری علمی ببریم و به صورت کامل سندرم میلودیسپلاستیک (MDS) را بررسی کنیم. این بیماری که به عنوان یکی از مهمترین مسائل دنیای پزشکی شناخته میشود، پر از جزئیات شگفتانگیز و نکات حیاتی است. پس همراه ما باشید و تا انتهای این مقاله مهیج را با علاقه فراوان دنبال کنید. آمادهاید؟ بیایید با هم به دنیای MDS قدم بگذاریم!
آشنایی با سندرم های میلودیسپلاستیک
در بیماری سندرم میلودیسپلاستیک (MDS)، کم خونی معمولاً با کاهش پلاکتها (ترومبوسیتوپنی) و کاهش نوتروفیلها (نوتروپنی) همراه است. این وضعیت با مغز استخوانی که ظاهر غیرطبیعی و معمولاً پرسلول دارد مشخص میشود، که نشان دهنده تولید ناکارآمد سلولهای خونی است.
در بیماران مبتلا به نوع کم خطر (low risk) سندرم میلودیسپلاستیک (MDS)، نارسایی مغز استخوان به طور عمده بر روند بالینی بیماری تاثیر میگذارد. این بیماران اغلب دچار کمخونی و علائم مرتبط با آن مانند خستگی و ضعف میشوند. اما در بیماران دیگر، وضعیت متفاوت است. در این دسته، میلوبلاستها که نوعی از سلولهای نابالغ خونی هستند، در مغز استخوان حضور دارند و تعدادشان بیشتر از حد معمول است.
همچنین، این بیماران دارای کروموزومهای غیرطبیعی هستند که نشاندهنده ناپایداری ژنتیکی است. این شرایط باعث میشود که بیماری ام دی اس در این افراد بسیار پرخطر باشد و احتمال پیشرفت آن به سمت لوسمی یا سرطان خون بالا باشد. بنابراین، نوع پرخطر این بیماری نیاز به نظارت دقیقتر و درمانهای جدیتری دارد تا از پیشرفت آن به سمت بیماریهای شدیدتر جلوگیری شود.
پیشنهاد میشود به کارگاه پزشکی بیماری زخم معده مراجعه فرمایید. سندرم میلودیسپلاستیک (MDS) میتواند به دلایل مختلفی خطرناک و حتی کشنده باشد. یکی از علل اصلی این خطر، کاهش شدید همه انواع سلولهای خونی است که شامل گلبولهای قرمز، گلبولهای سفید و پلاکتها میشود. این کاهش میتواند به مشکلات جدی مانند کمخونی شدید، عفونتهای مکرر و خونریزیهای کنترلنشده منجر شود. همچنین، اگر این سندرم به لوسمی (سرطان خون) تبدیل شود، درمان آن بسیار دشوار و در بسیاری از موارد غیر ممکن خواهد بود.
با این حال، باید توجه داشت که بسیاری از بیماران، به ویژه افراد مسن، نه به دلیل خود سندرم میلودیسپلاستیک بلکه به علت بیماریهای دیگری که همزمان با این سندرم دارند، از دنیا میروند. این بیماریهای همزمان ممکن است شامل مشکلات قلبی، دیابت، یا عفونتهای مزمن باشند که با ضعف سیستم ایمنی و کاهش سلولهای خونی ناشی از MDS تشدید میشوند. بنابراین، مدیریت جامع و دقیق وضعیت سلامت کلی بیماران مبتلا به سندرم میلودیسپلاستیک از اهمیت ویژهای برخوردار است تا خطرات ناشی از این بیماری و عوارض همراه آن کاهش یابد.
طبقهبندی
طبقهبندی سندرمهای میلودیسپلاستیک (MDS) به دو روش اصلی انجام میشود که هر یک از این روشها توسط معتبرترین نهادهای پزشکی بینالمللی توسعه یافتهاند:
طبقهبندی بر اساس سیستم فرانسوی-آمریکایی-بریتانیایی (FAB)
این سیستم طبقهبندی که توسط گروهی از متخصصان از فرانسه، آمریکا و بریتانیا ایجاد شده، اولین چارچوب رسمی برای دستهبندی MDS است. در این سیستم، سندرمهای میلودیسپلاستیک بر اساس تعداد و نوع سلولهای غیرطبیعی در مغز استخوان و خون طبقهبندی میشوند. همچنین، این سیستم میزان پیشرفت بیماری را از مرحلهی ابتدایی تا مراحل پیشرفتهتر که خطر تبدیل شدن به لوسمی (سرطان خون) بیشتر است، مشخص میکند.
طبقهبندی سازمان جهانی بهداشت (WHO)
سازمان جهانی بهداشت (WHO) یک سیستم طبقهبندی جامعتر و بهروزتر را برای MDS ارائه کرده است. این طبقهبندی بر اساس بررسیهای دقیقتر ژنتیکی و مولکولی انجام میشود و به پزشکان امکان میدهد تا با دقت بیشتری نوع و شدت بیماری را تشخیص دهند. سیستم WHO همچنین معیارهای دقیقی برای تشخیص انواع مختلف MDS دارد و به همین دلیل میتواند به بهبود تصمیمات درمانی و پیشبینیهای بالینی کمک کند.
با استفاده از این دو سیستم طبقهبندی، پزشکان میتوانند با دقت بیشتری نوع سندرم میلودیسپلاستیک را تشخیص داده و بهترین روشهای درمانی را برای بیماران خود انتخاب کنند. این طبقهبندیها به بهبود فرآیندهای درمانی و افزایش شانس بهبودی بیماران کمک میکنند.
طبقهبندی بر اساس سیستم FAB: سیستم طبقهبندی FAB (فرانسوی-آمریکایی-بریتانیایی) که در سال 1983 توسط گروهی از متخصصان ایجاد شد، یکی از روشهای مهم و اولیه برای دستهبندی سندرمهای میلودیسپلاستیک (MDS) است. این سیستم MDS را به پنج گروه اصلی تقسیم میکند که هر کدام ویژگیهای خاص خود را دارند:
کمخونی مقاوم به درمان (RA): این گروه شامل بیمارانی است که کمخونی دارند و مغز استخوان آنها حاوی سلولهای خونی نابالغ (بلاستها) کمتر از 5٪ است. بیماران RA اغلب با خستگی شدید و ضعف مواجه میشوند.
کمخونی مقاوم به درمان همراه با وجود سیدروبلاستهای حلقوی (RARS): در این گروه، علاوه بر کمخونی، تعداد زیادی از گلبولهای قرمز در مغز استخوان حاوی رسوبات آهن به شکل حلقوی (سیدروبلاستهای حلقوی) هستند. این نوع کمخونی معمولاً به درمانهای استاندارد پاسخ نمیدهد.
کمخونی مقاوم به درمان همراه با مقدار زیاد بلاست (RAEB): این گروه با وجود تعداد بیشتری سلولهای بلاست در مغز استخوان (5-20٪) مشخص میشود. بیماران RAEB در معرض خطر بالاتری برای پیشرفت به لوسمی حاد قرار دارند.
کمخونی مقاوم به درمان همراه با وجود مقدار زیاد سلولهای بلاست در حال تغییر (RAEB-t): این گروه شامل بیمارانی است که تعداد سلولهای بلاست در مغز استخوان آنها بین 20 تا 30 درصد است. RAEB-t یک مرحله پیشرفتهتر از RAEB است و خطر بیشتری برای تبدیل شدن به لوسمی حاد دارد.
لوسمی میلومونوسیتیک مزمن (CMML): در این گروه، علاوه بر ویژگیهای MDS، تعداد زیادی از سلولهای مونوسیتیک (نوعی از گلبولهای سفید) در خون و مغز استخوان وجود دارد. CMML ترکیبی از ویژگیهای سندرم میلودیسپلاستیک و لوسمی مزمن میلوئیدی است.
این طبقهبندی FAB به پزشکان کمک میکند تا نوع دقیق MDS را تشخیص دهند و بر اساس ویژگیهای خاص هر گروه، برنامه درمانی مناسبی را برای بیماران خود تنظیم کنند. فهم دقیق این دستهبندیها به بیماران و خانوادههایشان نیز کمک میکند تا بهتر با بیماری و مراحل درمان آن آشنا شوند.
در سال 2002، سازمان جهانی بهداشت (WHO) یک سیستم جدید و بهروز برای طبقهبندی سندرمهای میلودیسپلاستیک (MDS) معرفی کرد. این طبقهبندی تغییرات مهمی را نسبت به سیستمهای قبلی ایجاد کرد تا دقت و کارایی تشخیص و درمان بیماریها را افزایش دهد.
ادغام RAEB-t و لوسمی میلوئید حاد (AML): دراین طبقهبندی جدید، دو گروه RAEB-t (کمخونی مقاوم به درمان با مقدار زیاد سلولهای بلاست در حال تغییر) و لوسمی میلوئید حاد (AML) با هم ادغام شدند. این تغییر به دلیل شباهتهای بالینی و پیشآگهی این دو گروه انجام شد و هر دو به عنوان لوسمی حاد طبقهبندی شدند. این ادغام به پزشکان کمک میکند تا با دقت بیشتری بیماری را تشخیص داده و درمان مناسبی را پیشنهاد دهند.
رفتار بیماری CMML: در سیستم طبقهبندی WHO، لوسمی میلومونوسیتیک مزمن (CMML) به عنوان یک بیماری میلوپرولیفراتیو طبقهبندی شده است. این بیماری ویژگیهای همزمان سندرم میلودیسپلاستیک و بیماریهای میلوپرولیفراتیو را نشان میدهد و رفتار آن به گونهای است که نیازمند رویکردهای درمانی خاص خود میباشد.
تغییرات دیس مورفیک در ردههای خونی: یکی دیگر از تغییرات مهم در این طبقهبندی، جداسازی کمخونی مقاوم به درمان با تغییرات دیس مورفیک در رده اریتروئید (گلبولهای قرمز) از مواردی است که این تغییرات در چند رده خونی وجود دارند. این جداسازی به تشخیص دقیقتر و درک بهتری از نوع و شدت بیماری کمک میکند.
این طبقهبندی WHO با دقت بیشتری به ویژگیهای ژنتیکی و مولکولی بیماری میپردازد و به همین دلیل، ابزار مفیدی برای پزشکان در تشخیص و مدیریت بهتر سندرمهای میلودیسپلاستیک فراهم میکند. این رویکرد جامعتر و دقیقتر به درمان بیماران کمک میکند تا بهترین شانس ممکن برای مدیریت و بهبود بیماری خود را داشته باشند.
سازمان جهانی بهداشت (WHO) در یک بازبینی جامع، سیستم طبقهبندی دقیقتری برای سندرمهای میلودیسپلاستیک (MDS) ارائه کرده است. این طبقهبندی به شرح زیر است:
سندرم میلودیسپلاستیک با دیسپلازی تکردهای
- کمخونی مقاوم (RA): بیمارانی که فقط با کمخونی مواجه هستند و سایر ردههای خونی آنها طبیعی است.
- نوتروپنی مقاوم (RN): بیمارانی که تنها کاهش نوتروفیلها (نوعی گلبول سفید) دارند.
- ترومبوسیتوپنی مقاوم (RT): بیمارانی که تنها کاهش پلاکتها دارند.
سندرم میلودیسپلاستیک با دیسپلازی چند ردهای: این گروه شامل بیمارانی است که دچار ناهنجاری در بیش از یک رده خونی هستند. این وضعیت پیچیدهتر بوده و نیازمند نظارت دقیقتری است.
کمخونی مقاوم با سیدروبلاستهای حلقوی (RARS): در این گروه، گلبولهای قرمز حاوی رسوبات آهن به شکل حلقوی هستند که به درمانهای معمول پاسخ نمیدهند.
سیتوپنیهای مقاوم با دیسپلازی چند ردهای (RCMLD): این گروه شامل بیمارانی است که در چندین رده خونی (مانند گلبولهای قرمز، سفید و پلاکتها) دچار کاهش شدید هستند.
کمخونی مقاوم با تعداد زیادی بلاست نوع 1 (RAEB-1): این نوع شامل بیمارانی است که تعداد سلولهای بلاست در مغز استخوان آنها بین 5 تا 9 درصد است.
کمخونی مقاوم با تعداد زیادی بلاست نوع 2 (RAEB-2): در این نوع، تعداد سلولهای بلاست در مغز استخوان بین 10 تا 19 درصد است، که نشاندهنده خطر بالاتر تبدیل به لوسمی حاد است.
دیسپلازی مغز استخوان مرتبط با حذف منفرد Del 5q: این نوع شامل بیمارانی است که یک ناهنجاری ژنتیکی خاص به نام حذف منفرد Del 5q دارند. این گروه اغلب به درمانهای خاصی پاسخ مثبت میدهند.
بیماری MDS دوران کودکی
سیتوپنی مقاوم کودکی (RCC): این نوع شامل کودکانی است که با کاهش شدید سلولهای خونی مواجه هستند و نیاز به مراقبتهای ویژه دارند.
سایر مواردی که طبقهبندی نشدهاند (MDS-U): این گروه شامل موارد نادری است که به سایر دستهبندیها نمیگنجند و نیاز به بررسیهای بیشتر و درمانهای خاص دارند.
این طبقهبندی دقیق و جامع به پزشکان کمک میکند تا با دقت بیشتری بیماری را تشخیص داده و برای هر بیمار برنامه درمانی مناسبی تدوین کنند. این سیستم طبقهبندی نه تنها به درک بهتر بیماری کمک میکند، بلکه باعث بهبود روند درمان و افزایش کیفیت زندگی بیماران میشود.
تشخیص سندرم میلودیسپلاستیک (MDS) ممکن است چالشبرانگیز باشد، زیرا شناسایی دقیق علائم و نشانههای بیماری نیازمند تمایز و بررسی دقیق است. طبقهبندی تشخیصی دقیق نیز به تخصص یک هماتوپاتولوژیست آگاه از جدیدترین روشها و استانداردهای دستهبندی نیاز دارد. با این حال، آشنایی کافی متخصصان داخلی و پزشکان مراقبت اولیه با سندرم میلودیسپلاستیک اهمیت زیادی دارد. این آگاهی باعث میشود که بیماران به سرعت به یک فوق تخصص هماتولوژی ارجاع داده شوند.
دلیل این اهمیت، وجود درمانهای جدید و موثری است که میتوانند عملکرد خونسازی مغز استخوان را بهبود بخشند. استفاده بهموقع و منطقی از این درمانهای حمایتی میتواند به شکل چشمگیری کیفیت زندگی بیماران را ارتقا دهد.
بنابراین، همکاری نزدیک میان پزشکان مراقبت اولیه و متخصصان هماتولوژی برای ارائه بهترین مراقبتهای ممکن به بیماران ضروری است. این همکاری نه تنها به تشخیص سریعتر و دقیقتر کمک میکند، بلکه امکان دسترسی بیماران به جدیدترین و موثرترین روشهای درمانی را نیز فراهم میسازد.
در نتیجه، افزایش دانش و آگاهی در میان پزشکان و تیمهای درمانی میتواند به بهبود نتایج درمانی و افزایش رضایت و کیفیت زندگی بیماران مبتلا به سندرم میلودیسپلاستیک منجر شود.
شیوع و بروز بیماری سندرم میلودیسپلاستیک (MDS)
سندرم میلودیسپلاستیک (MDS) عمدتاً در افراد مسن دیده میشود، به طوری که متوسط سن شروع این بیماری بیش از ۷۰ سال است. این بیماری در مردان کمی بیشتر از زنان رخ میدهد.
میزان بروز و شیوع
میلودیسپلازی یکی از اشکال نسبتاً شایع نارسایی مغز استخوان است. میزان بروز این بیماری در کل جمعیت بین ۳۵ تا بیش از ۱۰۰ نفر در هر یک میلیون نفر است. اما در افراد مسن، این میزان به ۱۲۰ تا بیش از ۵۰۰ نفر در هر یک میلیون نفر میرسد. این ارقام نشان میدهند که با افزایش سن، احتمال بروز MDS نیز افزایش مییابد.
شیوع در کودکان
ابتلا به سندرم میلودیسپلاستیک در کودکان نادر است. با این حال، لوسمی مونوسیتیک مزمن (CMML) ممکن است در برخی از کودکان مشاهده شود. این نوع لوسمی نیز از دسته بیماریهای نادر در کودکان محسوب میشود.
میلودیسپلازی ثانویه
میلودیسپلازی ثانویه یا ناشی از درمان به سن بیمار ارتباط مستقیمی ندارد و ممکن است در هر سنی رخ دهد. این نوع میلودیسپلازی معمولاً به دنبال درمانهای خاصی مانند شیمیدرمانی یا پرتودرمانی ظاهر میشود.
روند رو به افزایش
میزان وقوع MDS در سالهای اخیر افزایش یافته است. این افزایش ناشی از دو عامل اصلی است:
1. تشخیص بهتر: پزشکان امروزه با آگاهی بیشتر و ابزارهای تشخیصی دقیقتر، قادر به شناسایی این بیماری در مراحل اولیهتر هستند.
2. افزایش سن جمعیت: با توجه به افزایش میانگین سنی جمعیت، تعداد افراد در معرض خطر ابتلا به MDS نیز بیشتر شده است.
اهمیت آگاهی و تشخیص
آگاهی از شیوع و بروز سندرم میلودیسپلاستیک به پزشکان و متخصصان کمک میکند تا با دقت بیشتری این بیماری را تشخیص داده و درمانهای مناسب را برای بیماران فراهم کنند. این اطلاعات همچنین به بیماران و خانوادههایشان کمک میکند تا با درک بهتری از بیماری، به موقع به دنبال مراقبتهای پزشکی مناسب باشند و بهبود کیفیت زندگی خود را ارتقا دهند.
علت سندرم میلودیسپلاستیک (MDS) چیست؟
سندرم میلودیسپلاستیک (MDS) یک بیماری پیچیده است که عوامل متعددی میتوانند در ایجاد آن نقش داشته باشند. این عوامل شامل عوامل محیطی، ژنتیکی و حتی تأثیرات درمانهای قبلی میشوند. در ادامه به بررسی جزئیتر این عوامل میپردازیم:
عوامل محیطی
پرتوتابی و بنزن: قرار گرفتن در معرض مواد شیمیایی مضر مانند بنزن و پرتوتابی، از عوامل شناختهشده در افزایش خطر ابتلا به MDS هستند. این مواد میتوانند به سلولهای مغز استخوان آسیب برسانند و تغییرات ژنتیکی ایجاد کنند که به توسعه بیماری منجر میشود.
میلودیسپلازی ثانویه
سمیت ناشی از درمانهای ضد سرطان: میلودیسپلازی ثانویه به عنوان یک عارضه دیررس از درمانهای ضد سرطان شناخته میشود. این نوع MDS معمولاً به دنبال ترکیبی از پرتودرمانی و استفاده از داروهای آلکیلهکننده مانند بوسولفان (Busulfan)، نیتروز اوره یا پروکاربازین (Procarbazine) و داروهای مهارکننده توپوایزومراز رخ میدهد.
شرایط مرتبط با بیماری
کمخونی آپلاستیک اکتسابی و کمخونی فانکونی: هر دو این شرایط میتوانند به MDS تبدیل شوند. کمخونی آپلاستیک اکتسابی معمولاً ناشی از درمانهای سرکوبگر ایمنی است، در حالی که کمخونی فانکونی یک اختلال ژنتیکی است که باعث نارسایی مغز استخوان میشود.
نقش افزایش سن
آسیب تجمعی داخلی و محیطی: سندرم میلودیسپلاستیک به عنوان یک بیماری ناشی از افزایش سن شناخته میشود. با افزایش سن، سلولهای مغز استخوان دچار آسیبهای تجمعی میشوند که میتواند منجر به توسعه MDS شود.
ناپایداری کروموزومی و ژنتیک
اختلالات ژنتیکی و کروموزومی: اختلالات کروموزومی در حدود نیمی از بیماران مبتلا به MDS یافت میشوند. ناپایداری کروموزومی و جهشهای ژنتیکی هر دو نقش مهمی در توسعه بیماری دارند. این اختلالات میتوانند شامل کم یا اضافه شدن کروموزوم (آنوپلوئیدی) و جابجایی کروموزومی (ترانسلوکاسیون) باشند.
تشخیص و تحلیل ژنتیکی
تستهای آزمایشگاهی پیشرفته: تستهای حساستر آزمایشگاهی مانند هیبریدسازی ژنومیک مقایسهای (CGH) و پلیمورفیسم یگانه نوکلئوتید (SNPs) به شناسایی اختلالات کروموزومی در بیماران کمک میکنند. ساییدگی تسریع شده تلومر نیز میتواند ژنوم را در نارسایی مغز استخوان بیثبات کند.
جهشهای سوماتیک و ژنتیکی
نقش جهشهای سوماتیک: بیش از 100 ژن با جهشهای سوماتیک مکرر در سلولهای مغز استخوان شناسایی شدهاند که برخی از آنها در لوسمی میلوئیدی حاد (AML) نیز حضور دارند. جهشهای مشخصی مانند SF3B1 با آنمی سیدروبلاستیک مرتبط هستند.
پیشآگهی بیماری و جهشهای ژنتیکی: برخی جهشهای ژنتیکی با پیشآگهی بیماری ارتباط دارند. به عنوان مثال، نقصهای spliceosome معمولاً با پیشآگهی مطلوب همراه هستند، در حالی که جهشهای ژنتیکی مانند RUNX1، TP53، EZH2 و ASXL1 اثرات نامطلوبی دارند.
پاتوفیزیولوژی و تاثیرات ایمنی
پاتوفیزیولوژی ایمنی: یکی از زیرگروههای MDS، تریزومی 8، نشان داده است که بیماران اغلب پس از درمان با داروهای سرکوبگر ایمنی، بهبود شمارش سلولهای خونی را تجربه میکنند. نقش سیستمهای ایمنی، سیتوکینها و سلولهای آن، تعامل سلولی و محیط رقابتی داروینی در مغز استخوان دیسپلاستیک هنوز به طور کامل شناخته نشده است.
سندرم میلودیسپلاستیک یک بیماری چند عاملی است که با ترکیبی از عوامل محیطی، ژنتیکی و پاتوفیزیولوژیکی ایجاد میشود. درک بهتر این عوامل میتواند به تشخیص دقیقتر و ارائه درمانهای مؤثرتر برای بیماران کمک کند.
علائم سندرم میلودیسپلاستیک یا بیماری MDS چیست؟
سندرم میلودیسپلاستیک (MDS) یک بیماری پیچیده و چندوجهی است که علائم آن میتواند بسیار متنوع باشد. با این حال، برخی از علائم و نشانههای شایع این بیماری شامل موارد زیر است:
کمخونی
علامت غالب و ابتدایی: کمخونی یکی از اولین و شایعترین علائم MDS است. بیماران اغلب از شروع تدریجی علائمی مانند خستگی و ضعف، تنگی نفس و رنگ پریدگی شکایت میکنند. این علائم به تدریج ظاهر میشوند و ممکن است در ابتدا خفیف باشند.
علائم عمومی
- خستگی و ضعف: بیشتر بیماران احساس خستگی و ضعف میکنند که میتواند فعالیتهای روزمره آنها را تحت تاثیر قرار دهد.
- تنگی نفس: تنگی نفس به خصوص در هنگام فعالیتهای فیزیکی از دیگر نشانههای شایع است که ناشی از کاهش ظرفیت حمل اکسیژن در خون است.
- رنگ پریدگی: رنگ پریدگی ناشی از کاهش گلبولهای قرمز خون است و میتواند به راحتی در پوست و غشاهای مخاطی مشاهده شود.
بیماران بدون علامت
شناسایی طی بررسیهای معمول: حداقل نیمی از بیماران مبتلا به MDS بدون علائم بالینی هستند و تنها از طریق بررسیهای معمول شمارش سلولهای خون (CBC) تشخیص داده میشوند.
سابقه پزشکی
اهمیت سابقه شیمیدرمانی یا پرتودرمانی: وجود سابقه شیمیدرمانی یا پرتودرمانی در بیماران میتواند نشاندهنده خطر بالاتری برای توسعه MDS باشد. این عوامل میتوانند به آسیب مغز استخوان و در نتیجه ایجاد این سندرم منجر شوند.
علائم دیگر
تب و کاهش وزن: اگرچه این علائم بیشتر نشاندهنده روند میلوپرولیفراتیو هستند، اما در برخی موارد ممکن است در بیماران مبتلا به MDS نیز دیده شوند. تب و کاهش وزن نشانههای غیرمستقیمی هستند که میتوانند به پیچیدگی وضعیت بیمار اشاره کنند.
سندرم میلودیسپلاستیک (MDS) با مجموعهای از علائم و نشانههای متنوع همراه است که برخی از آنها به تدریج و به آرامی بروز میکنند. شناخت این علائم و توجه به سابقه پزشکی بیمار از اهمیت بالایی برخوردار است. تشخیص زودهنگام و دقیق میتواند به بهبود کیفیت زندگی بیماران و مدیریت بهتر بیماری کمک کند.
آیا بیماری MDS در کودکان نیز وجود دارد؟
سندرم میلودیسپلاستیک (MDS) در کودکان نادر است، اما هنگامی که تشخیص داده شود، احتمال وجود بیماریهای زمینهای ژنتیکی بیشتر میشود. در ادامه به بررسی جزئیات بیشتری در مورد MDS در کودکان میپردازیم:
عوامل ژنتیکی و بیماریهای زمینهای
سندرم داون: کودکان مبتلا به سندرم داون در معرض خطر بیشتری برای ابتلا به میلودیسپلازی قرار دارند. این ارتباط به دلیل ناپایداری کروموزومی و تغییرات ژنتیکی موجود در این سندرم است.
سابقه خانوادگی: وجود سابقه خانوادگی ممکن است نشاندهنده نوع ارثی بیماریهای مرتبط با کمخونی مانند کمخونی سیدروبلاستیک یا کمخونی فانکونی باشد. این اطلاعات میتوانند به تشخیص دقیقتر و مدیریت بهتر بیماری کمک کنند.
جهشهای ارثی GATA2: جهشهای ژنتیکی مانند سندرم Mono Mac که با افزایش استعداد به عفونتهای قارچی، میکوباکتری و ویروسی همراه است، میتوانند به ایجاد MDS در بیماران جوان منجر شوند. این جهشها باعث نقص در تعداد مونوسیتها، سلولهای کشنده طبیعی (Natural Killer Cells) و لنفوسیتها میشوند.
معاینه بالینی و علائم
- کمخونی: معاینه بالینی معمولاً تأیید میکند که کودکان مبتلا به MDS دارای علائم کمخونی هستند، از جمله خستگی، رنگ پریدگی و ضعف عمومی.
- بزرگی طحال (اسپلنومگالی): حدود 20 درصد از بیماران کودکان ممکن است با بزرگی طحال مواجه شوند که نیاز به توجه ویژه دارد.
- ضایعات پوستی غیرمعمول: برخی از ضایعات پوستی نادر مانند سندرم Sweet (درماتوز نوتروفیلیک تبدار) ممکن است با MDS رخ دهد. این ضایعات میتوانند نشانهای از وجود بیماریهای جدیتر باشند.
سندرمهای خودایمنی و سرشتی
سندرمهای خود ایمنی: وقوع سندرمهای خودایمنی در کودکان مبتلا به MDS نیز غیرمعمول نیست و میتواند نشانهای از یک وضعیت پیچیدهتر باشد.
آنومالیهای استرئوتیپیک: در بیماران جوانتر، برخی آنومالیهای خاص میتوانند نشاندهنده سندرمهای سرشتی باشند. به عنوان مثال، قد کوتاه، انگشت شست غیرطبیعی در آنمی فانکونی، خاکستری شدن زودرس مو در تلومروپاتی و زگیلهای پوستی در کمبود GATA2 از جمله این علائم هستند.
اگرچه سندرم میلودیسپلاستیک در کودکان نادر است، اما وقتی تشخیص داده میشود، نیاز به بررسی دقیقتر برای شناسایی بیماریهای زمینهای و ژنتیکی دارد. شناخت این عوامل و توجه به علائم بالینی میتواند به تشخیص سریعتر و ارائه درمانهای مناسب برای بهبود کیفیت زندگی این بیماران کمک کند.
سندرم میلودیسپلاستیک (MDS) در کودکان
سندرم میلودیسپلاستیک (MDS) در کودکان یک پدیده نادر است. با این حال، وقتی این بیماری در کودکان تشخیص داده میشود، احتمال وجود یک بیماری زمینهای ژنتیکی افزایش مییابد. این بدان معناست که باید به دنبال عوامل ژنتیکی و بیماریهای مرتبط بود تا بتوان به درک بهتری از وضعیت بیمار رسید.
نمونهگیری مغز استخوان در بیماری MDS
در بیماران مبتلا به سندرم میلودیسپلاستیک (MDS)، نمونهگیری مغز استخوان یکی از مراحل مهم و اساسی در تشخیص و ارزیابی وضعیت بیمار است. مغز استخوان در بیشتر موارد طبیعی یا پرسلول است، اما در 20 درصد از موارد ممکن است به حدی کمسلول باشد که امکان اشتباه با آپلازی وجود داشته باشد.
ویژگیهای مغز استخوان در MDS
مغز استخوان در MDS هیچ ویژگی مشخص و منفردی برای تشخیص قطعی ندارد، اما برخی نشانهها به طور شایع مشاهده میشوند که میتوانند به تشخیص کمک کنند:
1. تغییرات بد شکل در سلولهای خونساز: ناهنجاریهای هستهای: این ناهنجاریها معمولاً در سلولهای خونساز مشاهده میشوند و یکی از نشانههای بارز بیماری هستند.
2. وجود سیدروبلاستهای حلقوی: رده اریتروئید: سیدروبلاستهای حلقوی در این رده به طور شایع دیده میشوند و میتوانند نشاندهنده اختلال در متابولیسم آهن باشند.
3. کمبود گرانولها و ناهنجاریهای هستهای: پیشسازهای گرانولوسیتها: این سلولها ممکن است کمبود گرانول و تعداد قطعات هستهای غیرطبیعی داشته باشند، همراه با افزایش میلوبلاستها که نشاندهنده نقص در روند طبیعی خونسازی است.
4. کاهش تعداد هستهها یا هستههای نامنظم مگاکاریوسیتها: مگاکاریوسیتها: این سلولها که در تولید پلاکتها نقش دارند، ممکن است دچار کاهش تعداد هستهها یا ناهنجاریهای هستهای شوند.
5. تغییرات مگالوبلاستیک: رده اریتروئید: این تغییرات شامل اختلال در تولید هموگلوبین و ناهنجاریهای هستهای است که میتواند به کمخونی و سایر مشکلات خونی منجر شود.
پیشآگهی و تحلیلهای ژنتیکی
پیشآگهی بیماری MDS به شدت با تعداد بلاستهای مغز استخوان مرتبط است. هرچه تعداد این بلاستها بیشتر باشد، پیشآگهی بیماری بدتر خواهد بود. برای تشخیص دقیقتر و شناسایی ناهنجاریهای ژنتیکی، از روشهای پیشرفتهتری مانند تجزیه و تحلیل سیتوژنتیک و هیبریدسازی فلورسنت درجا (FISH) استفاده میشود. این روشها میتوانند ناهنجاریهای کروموزومی را که ممکن است در ایجاد و پیشرفت MDS نقش داشته باشند، شناسایی کنند.
نمونهگیری مغز استخوان و تحلیل دقیق ویژگیهای آن، ابزارهای حیاتی در تشخیص و ارزیابی سندرم میلودیسپلاستیک هستند. شناخت و تفسیر صحیح این ویژگیها به پزشکان کمک میکند تا برنامههای درمانی موثرتری برای بیماران خود ارائه دهند و پیشآگهی بیماری را بهبود بخشند.
چه بیماریهایی میتوانند علائم سندرم میلودیسپلاستیک را تقلید کنند؟
تشخیص سندرم میلودیسپلاستیک (MDS) میتواند چالشبرانگیز باشد زیرا برخی از بیماریها و شرایط دیگر ممکن است علائم مشابهی ایجاد کنند. برای اطمینان از تشخیص صحیح، بررسی دقیق و انجام آزمایشهای مناسب ضروری است.
کمبود ویتامینها
ویتامین B12 و فولات: کمبود این ویتامینها میتواند علائمی مشابه MDS ایجاد کند. برای اطمینان از عدم وجود این کمبودها، آزمایشات خونی مناسب باید انجام شود. کمبود ویتامین B12 و فولات میتواند منجر به کمخونی مگالوبلاستیک شود که علائمی مانند خستگی، ضعف و مشکلات خونی دارد.
ویتامین B6: کمبود ویتامین B6 نیز میتواند علائمی مشابه ایجاد کند. در صورت وجود سیدروبلاستهای حلقوی در مغز استخوان، میتوان این کمبود را با یک دوره درمان آزمایشی با پیریدوکسین ارزیابی کرد.
سایر عوامل
عفونتهای ویروسی حاد: دیسپلازی مغز استخوان ممکن است در نتیجه عفونتهای ویروسی حاد مشاهده شود. این تغییرات معمولاً موقتی هستند و با برطرف شدن عفونت به حالت طبیعی بازمیگردند.
عوارض دارویی و مسمومیت با مواد شیمیایی: برخی داروها و مواد شیمیایی میتوانند دیسپلازی مغز استخوان را تقلید کنند. این شرایط نیز معمولاً موقتی هستند و با قطع مصرف دارو یا رفع مسمومیت بهبود مییابند.
تشخیصهای چالشبرانگیز
میلودیسپلازی کمسلول و آپلازی: افتراق بین میلودیسپلازی کمسلول و آپلازی میتواند مشکل باشد. آپلازی به کاهش شدید سلولهای مغز استخوان اطلاق میشود که ممکن است با MDS اشتباه گرفته شود.
کمخونی مقاوم به درمان با بلاست زیاد و مراحل اولیه لوسمی حاد: افتراق بین کمخونی مقاوم به درمان با بلاست زیاد و مراحل اولیه لوسمی حاد نیز چالشبرانگیز است. این دو وضعیت میتوانند علائم بسیار مشابهی داشته باشند.
معیارهای تشخیصی
سازمان بهداشت جهانی (WHO): طبق طبقهبندی WHO، وجود 20 درصد سلول بلاست در مغز استخوان به عنوان معیاری برای افتراق لوسمی میلوئید حاد (AML) از میلودیسپلازی در نظر گرفته شده است. این معیار به پزشکان کمک میکند تا تشخیص دقیقتری داشته باشند.
بیماریهای ژنتیکی زمینهای
در بیماران جوان: در بیماران جوان، باید به بیماریهای ژنتیکی زمینهای و مستعد کننده توجه ویژهای شود. این بیماریها میتوانند علائمی مشابه MDS ایجاد کنند و نیاز به بررسی دقیقتر دارند.
تشخیص دقیق سندرم میلودیسپلاستیک نیازمند ارزیابی جامع و دقیق است. در نظر گرفتن کمبود ویتامینها، عفونتها، عوارض دارویی و بیماریهای ژنتیکی میتواند به افتراق این بیماری از سایر شرایط مشابه کمک کند. همکاری نزدیک بین پزشکان و استفاده از معیارهای تشخیصی مناسب میتواند به تشخیص سریعتر و دقیقتر منجر شود و در نتیجه، برنامهریزی درمانی مؤثرتری را فراهم آورد.
طول عمر بیماران مبتلا به سندرم میلودیسپلاستیک (MDS)
در سندرم میلودیسپلاستیک (MDS)، متوسط طول عمر بیماران به شدت متغیر است و بستگی به نوع و شدت بیماری دارد:
- کمخونی -5q یا کمخونی سیدروبلاستیک: این بیماران معمولاً طول عمری چند ساله دارند و پیشآگهی نسبتاً بهتری دارند.
- کمخونی مقاوم به درمان با وجود بلاست فراوان یا پانسیتوپنی شدید همراه با مونوزومی ۷: این بیماران معمولاً طول عمری چند ماهه دارند و پیشآگهی ضعیفتری دارند.
سیستم طبقهبندی پیشآگهی بینالمللی (IPSS)
برای کمک به تعیین طول عمر و میزان مرگ و میر بیماران مبتلا به MDS، از سیستم طبقهبندی پیشآگهی بینالمللی (IPSS) استفاده میشود. این سیستم به پزشکان امکان میدهد تا بر اساس معیارهای خاصی مانند تعداد بلاستها در مغز استخوان، ناهنجاریهای کروموزومی و تعداد سلولهای خونی، پیشآگهی دقیقتری را برای بیماران ارائه دهند.
حتی در موارد کمخطر، مرگ و میر قابل توجهی مشاهده میشود. این نشان میدهد که MDS یک بیماری جدی است که نیاز به مراقبت و نظارت دقیق دارد.
علت مرگ و میر در بیماران MDS
اکثر بیماران مبتلا به MDS به علت عوارض ناشی از کاهش سلولهای خونی میمیرند و نه به علت تبدیل بیماری به سرطان خون. این عوارض شامل عفونتهای شدید، خونریزیهای غیرقابل کنترل و نارساییهای عضوهای حیاتی میشود. احتمالاً در یک سوم موارد، علت مرگ مستقیماً به MDS مربوط نمیشود و به دلایل دیگری رخ میدهد.
عوامل پیشآگهی ضعیف
چندین عامل میتوانند با پیشآگهی ضعیف و افزایش مرگ و میر در بیماران مبتلا به MDS همراه باشند:
- تشدید پانسیتوپنی: کاهش شدید تمام سلولهای خونی (گلبولهای قرمز، گلبولهای سفید و پلاکتها) میتواند نشاندهنده پیشآگهی ضعیف باشد.
- تشخیص ناهنجاریهای کروموزومی جدید: طی بررسیهای سیتوژنتیکی، شناسایی ناهنجاریهای کروموزومی جدید میتواند نشاندهنده پیشرفت بیماری باشد.
- افزایش تعداد سلولهای بلاست: افزایش تعداد سلولهای بلاست در مغز استخوان نشاندهنده خطر بالاتر تبدیل بیماری به لوسمی میلوئید حاد (AML) است.
- فیبروز مغز استخوان: وجود فیبروز در مغز استخوان میتواند نشاندهنده پیشآگهی ضعیف باشد.
طول عمر و میزان مرگ و میر بیماران مبتلا به MDS به شدت وابسته به نوع و شدت بیماری است. استفاده از سیستم طبقهبندی پیشآگهی بینالمللی (IPSS) به پزشکان کمک میکند تا پیشآگهی دقیقتری ارائه دهند و برنامه درمانی مناسبی برای بیماران تدوین کنند. توجه به عوامل پیشآگهی ضعیف و مدیریت عوارض ناشی از کاهش سلولهای خونی میتواند به بهبود کیفیت زندگی و افزایش طول عمر بیماران کمک کند.
درمان سندرم میلودیسپلاستیک (MDS)
درمان سندرم میلودیسپلاستیک (MDS) چالشبرانگیز است و معمولاً نتایج مطلوبی به همراه ندارد. با این حال، اخیراً داروهای جدیدی برای درمان این بیماری تأیید شدهاند که امیدواریهای جدیدی را برای بیماران به ارمغان آوردهاند. چندین رژیم درمانی نه تنها شمارش سلولهای خونی را افزایش میدهند بلکه شروع سرطان خون یا لوسمی را به تأخیر میاندازند و طول عمر بیماران را بهبود میبخشند. انتخاب درمان مناسب، تجویز درمان و مدیریت عوارض آن نیازمند تخصص و تجربه پزشکان هماتولوژیست است.
درمانهای اصلی MDS
پیوند مغز استخوان: پیوند مغز استخوان اصلیترین درمان برای سندرم میلودیسپلاستیک است. بیماران تحت پیوند مغز استخوان معمولاً طول عمر بیشتری دارند و آمارها نشان میدهد که طول عمر بیماران پس از پیوند مغز استخوان در طی 3 سال به حدود 50 درصد میرسد و این میزان در حال افزایش است.
دهندگان غیر خویشاوند: استفاده از دهندگان غیر خویشاوند که با بیمار سازگار شدهاند، نتایجی مشابه با پیوند از خواهر و برادر دارد. حتی بیماران در دهه 50 و 60 زندگی خود نیز با موفقیت تحت پیوند قرار میگیرند. با این حال، مرگ و میر و عوارض مرتبط با پیوند با افزایش سن دریافتکننده افزایش مییابد.
چالشهای پیوند: تصمیمگیری برای پیوند مغز استخوان در بیماران پرخطر به دلیل احتمال بالای مرگ و میر یا عود بیماری بسیار مشکل است. در مقابل، بیماران کمخطر که میتوانند پیوند را تحمل کنند، ممکن است با درمانهای تهاجمی کمتر و مدیریت مناسب برای سالها به خوبی زندگی کنند.
مقاومت به شیمیدرمانی
بیماری MDS معمولاً در برابر رژیمهای شیمیدرمانی سیتوتوکسیک مقاوم است. مشابه با لوسمی میلوئید حاد (AML) در افراد مسن، درمانهای شیمیدرمانی اغلب با مسمومیت دارویی همراه است که میتواند کشنده باشد و اگر بهبودی حاصل شود، معمولاً کوتاهمدت است.
داروهای جدید و رژیمهای درمانی
پیشنهاد میشود به کارگاه پزشکی مولتیپل میلوما مراجعه فرمایید. تایید داروهای جدید برای درمان MDS، امید تازهای برای بیماران و پزشکان به همراه داشته است. این داروها میتوانند شمارش سلولهای خونی را افزایش دهند و شروع لوسمی را به تأخیر بیندازند، به این ترتیب طول عمر بیماران را بهبود میبخشند.
مدیریت مسمومیت
مدیریت مسمومیتهای ناشی از درمان نیازمند دقت و تخصص فراوان است. پزشکان هماتولوژیست باید با دقت برنامهریزی و تجویز درمان کنند تا از عوارض جدی و کشنده جلوگیری کنند.
درمان سندرم میلودیسپلاستیک (MDS) به دلیل پیچیدگیهای آن نیازمند تخصص و تجربه است. پیوند مغز استخوان به عنوان درمان اصلی، امیدهای زیادی را برای بیماران به همراه دارد، اما چالشهای خاص خود را نیز دارد. با تایید داروهای جدید و بهبود روشهای درمانی، بیماران MDS میتوانند به زندگی بهتری امیدوار باشند. توجه دقیق به مدیریت مسمومیت و انتخاب درمانهای مناسب میتواند به بهبود کیفیت زندگی و افزایش طول عمر بیماران کمک کند.
داروهای تعدیلکننده اپیژنتیک
این داروهای جدید که به عنوان تعدیلکنندههای اپیژنتیک طبقهبندی میشوند، با تغییر تنظیم ژنی از طریق مکانیسم برداشتن متیلاسیون عمل میکنند. این فرآیند به سلولهای خونی بالغ اجازه میدهد تا از سلولهای ریشهای میلودیسپلاستیک غیرطبیعی تمایز پیدا کنند. دو داروی اصلی در این گروه عبارتند از:
آزاسیتیدین
این دارو که به طور شایع در کلینیکهای نارسایی مغز استخوان استفاده میشود، میتواند شمارش سلولهای خونی را در بیماران مبتلا به MDS بهبود بخشد و نسبت به بهترین درمانهای حمایتی، اندکی میزان بقای بیماران را افزایش دهد. آزاسیتیدین به مدت 7 روز متوالی در فواصل 4 هفتهای و حداقل برای 4 دوره به صورت تزریق زیرجلدی تجویز میشود. پاسخ به درمان به تجویز مداوم دارو وابسته است و بسیاری از بیماران پس از مدتی دیگر پاسخ نمیدهند و با سیتوپنی مکرر یا پیشرفت به سمت AML مواجه میشوند.
دسیتابین
این دارو شباهت زیادی به آزاسیتیدین دارد ولی قویتر است. حدود 30 تا 50 درصد از بیماران بهبود در شمارش سلولهای خونی را تجربه میکنند و این پاسخ تقریباً یک سال دوام دارد. دسیتابین معمولاً به صورت تزریق داخل وریدی مداوم و در رژیمهایی با دوزهای متفاوت به مدت 3 تا 10 روز در دورههای تکرار شونده تجویز میشود.
عوارض جانبی
سمیت اصلی هر دو دارو سرکوب رده میلوئید است که منجر به تشدید اختلال شمارش سلولی میشود. علائم دیگر مرتبط با شیمیدرمانی نیز به طور شایع رخ میدهند.
لنالیدوماید (Lenalidomide)
این دارو، یکی از مشتقات تالیدومید، دارای الگوی سمیت مناسبتری است و در بیماران مبتلا به MDS با سندرم -5q در بهبود کمخونی بسیار مؤثر بوده است. بسیاری از بیماران از وابستگی به انتقال خون رها میشوند و سطح هموگلوبین طبیعی یا نزدیک به طبیعی به دست میآورند. علاوه بر این، وضعیت سیتوژنتیک آنها نیز بهبود مییابد.
- روش تجویز: لنالیدوماید به صورت خوراکی تجویز میشود و بیشتر بیماران در عرض سه ماه از شروع درمان بهبود مییابند.
- عوارض جانبی: سمیتهای این دارو شامل سرکوب رده میلوئید، افزایش خطر ترومبوز وریدهای عمقی (DVT) و آمبولی ریوی (PTE) است.
درمانهای سرکوب ایمنی
سرکوب ایمنی، مشابه روشهای درمانی کمخونی آپلاستیک، میتواند باعث رهایی پایدار بیمار از وابستگی به انتقال خون و بهبود بقا شود. داروهایی مانند سیکلوسپورین، ATG یا پادتن تکدودمانی ضد 52-CD به ویژه در بیماران میلودیسپلاستیک جوانتر (کمتر از ۶۰ سال) و با تطابق بافتی HLA-DR15 مؤثر هستند.
عوامل رشد خونساز
عوامل رشد خونساز انسانی میتوانند تعداد سلولهای خونی را افزایش دهند. اریتروپویتین به تنهایی یا همراه با G-CSF میتواند میزان هموگلوبین را بهبود بخشد. این درمان به ویژه در بیمارانی که سطح اریتروپویتین سرم پایین دارند و نیاز کمتری به انتقال خون دارند، موثر است.
اصول درمانهای حمایتی
درمانهای حمایتی در MDS مشابه کمخونی آپلاستیک است. انتقال خون باید توأم با آهنگیری باشد تا بیمار به هموکروماتوز ثانویه مبتلا نشود. علیرغم بهبودهایی که در درمان دارویی به دست آمده، بیشتر بیماران مبتلا به MDS برای سالها با کمخونی یا آنمی مواجه خواهند بود.
داروهای جدید در درمان سندرم میلودیسپلاستیک (MDS) امیدهای جدیدی برای بیماران و پزشکان فراهم کردهاند. این داروها میتوانند به بهبود شمارش سلولهای خونی، تاخیر در شروع لوسمی و افزایش طول عمر بیماران کمک کنند. با این حال، مدیریت عوارض جانبی و انتخاب دقیق روشهای درمانی برای هر بیمار نیازمند تخصص و تجربه پزشکان هماتولوژیست است.
نتیجهگیری
سندرم میلودیسپلاستیک (MDS) همچنان به عنوان یکی از چالشبرانگیزترین بیماریهای خون و مغز استخوان شناخته میشود. این بیماری، که اغلب به عنوان پیشلوسمی شناخته میشود، مسیر پیچیدهای از تغییرات ژنتیکی و سلولی را طی میکند که میتواند منجر به کاهش تولید سلولهای خونی سالم و ایجاد علائمی مانند خستگی، عفونتهای مکرر و خونریزی شود.
با وجود پیچیدگیهای این بیماری، پیشرفتهای علمی اخیر نشان دادهاند که امید به زندگی برای بیماران مبتلا به MDS در حال بهبود است. داروهای تعدیلکننده اپیژنتیک مانند آزاسیتیدین و دسیتابین، توانستهاند به طور مؤثری در افزایش شمارش سلولهای خونی و بهبود کیفیت زندگی بیماران نقش ایفا کنند. همچنین، درمانهای نوآورانه مانند لنالیدوماید، به خصوص در بیماران با سندرم -5q، نتایج چشمگیری را به همراه داشتهاند.
پیوند مغز استخوان، به عنوان یکی از درمانهای اصلی، همچنان امید بسیاری از بیماران و خانوادههایشان را زنده نگه میدارد. با پیشرفتهای مداوم در تطبیق دهندگان و کاهش عوارض پیوند، این روش درمانی میتواند به بیماران امکان بازگشت به زندگی عادی را بدهد.
تلاشهای مداوم در زمینه تحقیقات و نوآوریهای درمانی، نویدبخش آیندهای روشنتر برای بیماران مبتلا به MDS است. پزشکان و پژوهشگران همواره به دنبال روشهای جدید و موثرتری برای مدیریت و درمان این بیماری هستند، و این تلاشها هر روز نتایج امیدوارکنندهتری به همراه دارد.
در پایان، سندرم میلودیسپلاستیک اگرچه یک چالش بزرگ در دنیای پزشکی است، اما با همکاری بینالمللی، پژوهشهای بیوقفه و امید به درمانهای نوین، بیماران مبتلا به این بیماری میتوانند به آیندهای بهتر و زندگی با کیفیتتر امیدوار باشند. با آگاهی و حمایتهای مستمر، میتوانیم این مبارزه را به یک پیروزی بزرگ تبدیل کنیم.